记忆的橡皮擦——阿尔兹海默病
【2019-09-21】

图片来源:千图网
阿尔兹海默病
“对于阿尔茨海默病患者来说,这是一个忘却疾病与健康、忘却悲伤与快乐,忘却爱与恨的病,而对于患者家属来说,护理亲人的过程,关于爱、关于痛,也关于思考。我们的亲人,他还活着,然而他的理性与感性都在渐渐离开你,相比起‘死别’,这种‘生离’或许更为残忍。”
阿尔茨海默病(Alzheimer's disease, AD)是一种进行性发展的神经系统退行性疾病,也是老年痴呆最重要的病因之一。至今人们对其病因的理解仍停留在“像雾像雨又像风”的阶段,但AD并未给人类留下太多的时间去揭开它的面纱,就已经汹涌而来。
1. 老龄化社会,“瘟疫”来袭
2018年美国公布的数据显示,AD已成为美国第六大死因,且死亡率以每年15.7%的速度迅速上升。如此迅猛的增长速度,给人们带来了莫大的恐慌。
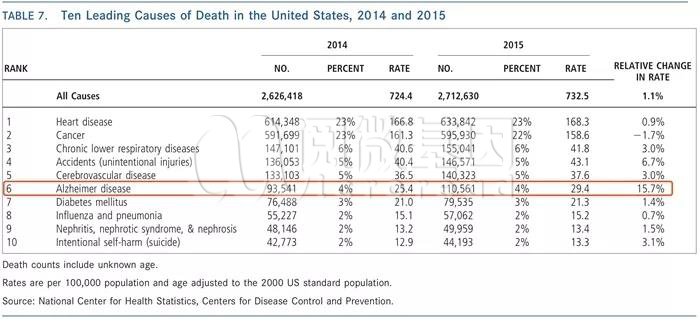
数据来源:Cancer statistics, 2018
国际阿尔茨海默病协会(ADI)于2018年9月发布《世界阿尔茨海默病2018年报告》显示,全球每3秒钟就有1例痴呆患者产生。2018年全球约有5千万人患有AD,到2050年这一数字将增至1.52亿,将是现在的三倍之多。

数据来源:World Alzheimer Report 2018
中国有1000万确诊的AD患者,占全球四分之一。预计到2050年,我国的老年人口大约会增长到4亿,AD症患者将达到2000万人。未来,很有可能一对夫妻赡养的4位80岁以上老人中,就有一位是阿尔茨海默病患者,它正像瘟疫一样一步步向我们走来。
2. “阿尔茨海默病”是一种怎样的疾病?
阿尔茨海默病被称为上帝最恶毒魔咒,它会缓慢而痛苦地带走一个人的认知、思考、行为能力,病人甚至无法正常说话、吃饭、找到回家的路。我们用一则短片来快速了解一下这种疾病。
视频来自网络
虽然大多数AD都是散发性的,但是科学家目前认为约70%的AD风险可归因于遗传因素。
✦ 一种特别罕见的家族性阿尔茨海默病(fAD,疾病占比<0.5%),可归因于三种基因的突变,分别是淀粉样蛋白基因(APP)、早衰蛋白1基因 (PSEN1)和早衰蛋白2基因 (PSEN2);✦ 对于散发性的AD,最重要的遗传因素就是载脂蛋白E(APOE)基因,研究发现,携带ε4基因型的人患AD的风险概率是ε3的4倍;✦ 利用数千个样本进行的全基因组关联研究已经确定了20多个遗传危险因素,包括炎症、胆固醇代谢和内囊泡循环途径上的各种基因。
通过对这些基因的联合检测和综合评估,就可以测算出一个相对准确的患病风险概率,并以此制定科学、个性化的健管方案,来预防或延缓AD的发生。
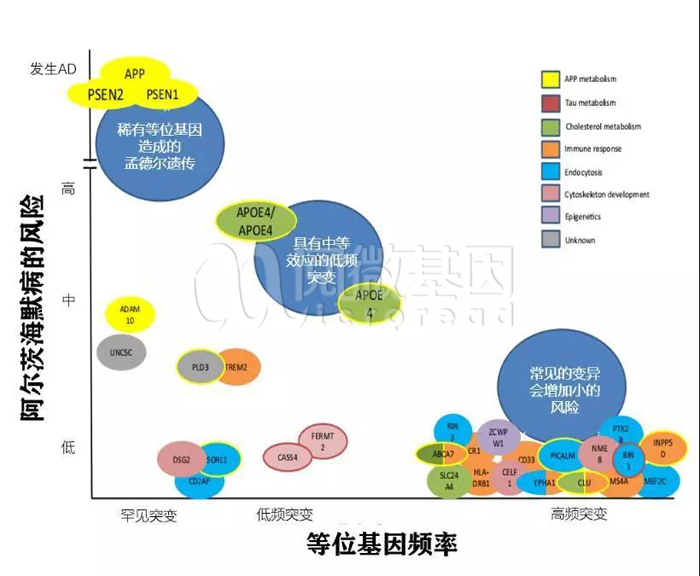
等位基因频率与阿尔兹海默病发病风险相关性
数据来源:Ca A Cancer Journal for Clinicians,2018
注:在有两种内部颜色的地方,基因涉及的途径不止一个。用黄色圈起来的基因被认为影响淀粉样蛋白的代谢;用红色圈起来的基因被认为影响tau蛋白的代谢。有两种颜色的基因,表示涉及多个代谢途径。
如果出于检测费用的考虑,我们不能把这些基因全部测完,那应该如何取舍呢?
✦ 对于罕见突变,虽然它的致病性很高,但因为携带这种基因型的人很少,也就是说绝大多数人检测的结果都是阴性的,所以它不适合给普通人群做筛查,而是对有家族遗传史的人更适合;✦ 对于高频突变,每一个基因的作用很小,需要做多个基因、多位点的联合分析,才能计算出一个相对准确的发病风险,检测的位点越多,费用也自然越高;✦ 对于像APOE之类的基因,既是低频突变(被检出的可能性相对较高),并有中等的致病效应(携带致病基因型的发病风险会显著升高),就比较适合给普通人群做筛查了。
3. 无药可用的恶疾
临床表现为认知功能下降、行为障碍、生活能力下降的阿尔茨海默病也有其自己特有的病理特征,那就是β淀粉样蛋白沉积形成的细胞外老年斑和神经细胞内神经元纤维缠结。除此之外,还有皮质弥漫性萎缩、脑沟回增宽、脑室扩大、神经元大量减少等病变。
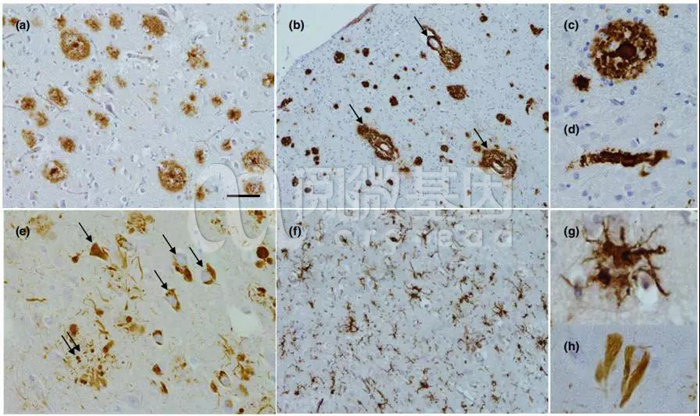
阿尔茨海默病的病理图片
图片来源:Ca A Cancer Journal for Clinicians,2018
如果是其他的疾病,可能还有很多药可用于治疗,但是对于阿尔茨海默病,我们的选择将非常有限。虽然自1998年以来,全世界已有上百次尝试开发治疗AD的有效药物,但大多折损于临床试验,目前仅有4种药物获得美国FDA的批准,他们分别是:
✦ 多奈哌齐:由日本卫材研发,1996年11月获FDA批准在美国上市,是目前唯一能治疗轻、中、重度AD的药物,也是常用药物中安全性和耐受性最好的一款老药;✦ 卡巴拉汀:由瑞士诺华研发,2000年4月获FDA批准在美国上市,是第一款获批用于治疗由帕金森病所致的轻中度AD的药物,且对于需要接受多种药物组合的患者安全性最高;✦ 加兰他敏:由强生研发,2001年2月获FDA批准在美国上市,主要针对有睡眠障碍的轻中度AD患者;✦ 美金刚:由FOREST LABS研发,2003年10月获FDA批准在美国上市,与前三款药物作用机制不同(前三款均为AChE抑制剂),美金刚为FDA批准的首个也是唯一一个N-甲基-D-天冬氨酸(NMDA)受体拮抗剂,其临床试验证明安全性和耐受性优于AChE抑制剂,也是目前市场上销售最好的AD药物。
美金刚
目前仅有的这几种药物,只能短时间内控制或改善认知和功能症状,并不能从根本上阻止或显著延缓病情恶化。虽然AD发病原因和机制目前还没有定论,即使AD药物研发困难重重,但科学家们并未就此放弃,在解救AD患者的道路上依旧前赴后继、越挫越勇。
今年3月份,脑洞大开的科学家们,尝试用40赫兹的光和声音来治疗阿尔茨海默病。这个治疗方法已经在小鼠身上起了作用,恢复了小鼠的认知能力。
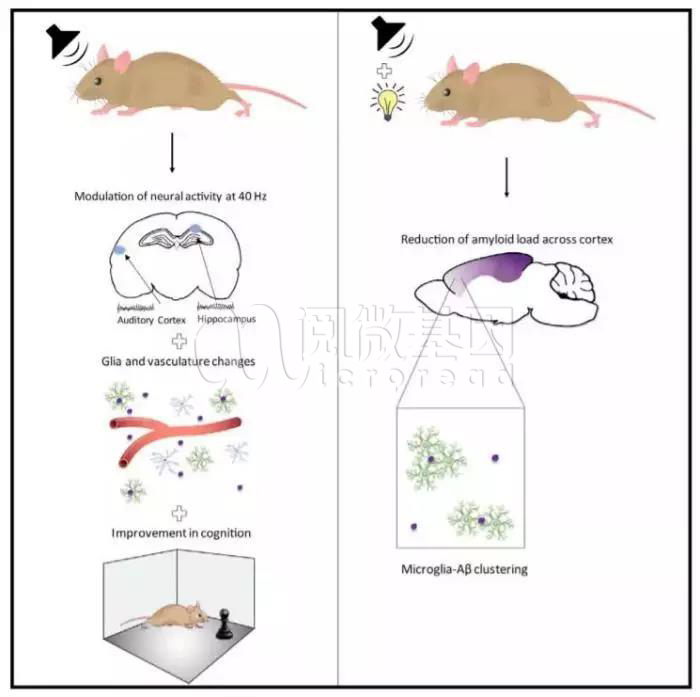
声音和光联合使用对小鼠大脑中胶质细胞数量的影响
来源:Cell,2019
注:大脑在工作时,会传播一定频率的电信号,其中频率较高的电信号(每秒30-90次)负责一些高强度精神活动,称为γ波。在大脑损伤、精神分裂和阿尔茨海默病等患者的大脑里,原本按部就班的γ波会被打乱。用40赫兹的光波或声波刺激大脑,可以减少β淀粉样蛋白和Tau蛋白浓度。而β淀粉样蛋白和Tau蛋白的积累,正好与阿尔茨海默病密切相关。实验中,声音和光的结合进一步扩大了影响范围,在大脑内侧前额叶皮层中也发现了数量增加的小胶质细胞。这些小胶质细胞在蛋白质斑块周围聚集,行使自己的清除功能。联合使用1周后,与没有接受刺激的小鼠相比,前额叶皮层总斑块体积减少了37%,数量减少了34%。
无论化学疗法,还是物理疗法,我们相信在不久的将来,科学家们一定能够找到治疗AD的灵丹妙药,来挽救我们弥足珍贵的记忆。
4. 未病先防,防患未然
虽然我们目前还不能治愈AD,但我们可以从一开始就阻止或者推迟它的发生。哪怕只能推迟5年或者10年,在全球范围来看也将会产生巨大的影响。
研究发现,约35%~50%的阿尔茨海默病有可以干预的危险因素和机制,也就是说,通过针对多种危险因素进行干预,我们有可能减少一半阿尔茨海默病的发生,举例如下:
✦ 比如,我们已知APOE ε4基因是阿尔茨海默病的一个重要遗传危险因素,就可以通过基因检测预判发病风险,进行针对性的预防(您所关注的阅微基因刚好可以干这件事);
✦ 比如,我们已证明北欧的高脂肪饮食习惯对预防AD有很好的效果,就可以建议高风险人群多吃鱼、好油、蔬菜和浆果,并减少牛奶、奶酪、盐和糖的摄入,来预防疾病;✦ 比如,我们知道可以通过改变一些生活方式来保护大脑。如预防牙周炎、戒烟、间歇性禁食、补充鱼油、运动、定期验血以监测胆固醇等等。✦ 我们还可以听从健身房教练、物理治疗师、护士以及心理学家们的建议,从多个方面预防AD的发生。
除此之外,AI智能的加入,也有望帮助我们尽早诊断AD。研究人员利用常用的脑部扫描技术开发的机器学习算法,可提早6年做出阿兹海默病诊断,为提早进行疾病干预带来了新的希望。

9月是阿尔茨海默病月,今年的主题是“从容面对 不再回避”。阅微基因的APOE基因检测,将助力您远离阿尔茨海默病困扰,享受完整记忆人生。
ApoE基因检测检测内容
ApoE基因热点突变
适用人群
• 有家族性老年痴呆、脑梗死、冠心病史者• 关注心脑血管疾病预防和保健的人群• 超重或三高(高血脂、高血压、高血糖)人群• 高热量饮食爱好者,长期处于疲劳亚健康状态人群
样本类型
• 外周血• 口腔黏膜上皮细胞
参考文献:
[1] Siegel, R. L., et al. (2018). Cancer statistics, 2018. Ca A Cancer Journal for Clinicians. DOI:10.3322/caac.21442
[2] C. A. Lane, et al. (2018). Alzheimer’s disease. European Journal of Neurology.
DOI:10.1111/ene.13439
[3]《World Alzheimer Report 2018 The state of the art of dementia research:New frontiers》
[4] Anthony J. M., et al., (2019), Multi-sensory Gamma Stimulation Ameliorates Alzheimer’s-Associated Pathology and Improves Cognition.Cell.
DOI: 10.1016/j.cell.2019.02.014
[5] Yiming D., et al.(2018). A Deep Learning Model to Predict a Diagnosis of Alzheimer Disease by Using 18F-FDG PET of the Brain. Radiological Society of North America.
DOI: 10.1148/radiol.2018180958







