近期多个科研团队证实ACE2(血管紧张素转化酶II)是此次新型冠状病毒SARS-CoV-2(此前被称为2019-nCoV)的细胞受体[1,2]此外,ACE2还是2002年SARS-CoV(中国首次发现——“非典”,辅助受体为CD209L)[3]和2004年HCoV-NL63的细胞受体(荷兰首次发现)。那么,冠状病毒的受体起什么作用呢?
它是帮助冠状病毒感染人体的元凶之一。冠状病毒感染宿主细胞,首先要特异性识别并粘附在宿主细胞表面,再突破宿主细胞膜的屏障,侵入宿主细胞内部。这次SARS-CoV-2能感染人体,就是因为SARS-CoV-2表面的S蛋白能“抓住”人体组织细胞表面的ACE2受体,使SARS-CoV-2与人体组织细胞发生膜融合,SARS-CoV-2得以进入人体。了解冠状病毒的结构、S蛋白及ACE2受体能帮助我们理解这个关键过程。
冠状病毒的基本结构
冠状病毒(Coronavirus, CoVs)是目前为止最长(26.2~31.7kb)的正义单链RNA [positive single strand RNA, (+) ssRNA]病毒(正义单链RNA病毒的RNA可以直接在宿主细胞内翻译,感染宿主细胞,相对应的为反义单链RNA病毒,其RNA必须先转变成正义RNA才能进行翻译,因此反义RNA病毒没有感染能力)。形态多样,但大多呈球形,平均直径80~120 nm。能够感染多种哺乳动物、鸟类,引起呼吸道、胃肠道和中枢神经系统疾病。
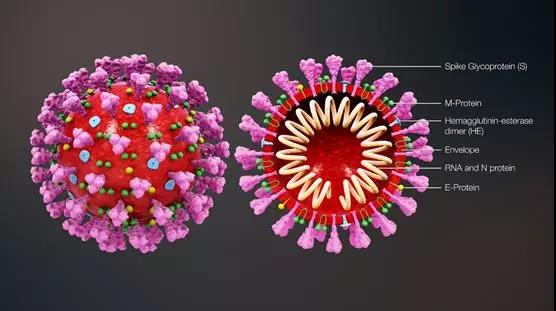
下图就是SARS-CoV-2的结构。它的单链RNA被衣壳蛋白包被,组成核衣壳(nucleocapsid-N protein),核衣壳外有脂质双层包膜(Envelope)。包膜由4个蛋白组成:E蛋白(E-Protein)、M蛋白(M-Protein)、HE蛋白(hemagglutinin esterase)及表面突起的「S蛋白」(Spike Glycoproteins)(E和M蛋白与病毒装配有关。S蛋白三聚体形成突起,伸出包膜表面,使整个病毒外形如王冠状,因此得名“冠状病毒”)。
新冠病毒3D示意图
(图源:https://www.scientificanimations.com/wiki-images/)
S蛋白
S蛋白属于I型病毒融合蛋白,且高度糖基化。S蛋白胞外区(ectodomain)有两个独特的功能结构域,即S1(近N端)和S2(近C端)。S1中的受体结合结构域RBD负责病毒和受体的结合(RBDs-receptor binding domains),S2负责病毒和宿主细胞的融合(S2中的融合肽FP-fusion peptide起主要作用)。S蛋白不仅与病毒感染过程有关,还可决定病毒能感染哪些宿主(S蛋白基因突变能改变病毒感染的宿主类型)。
利用S蛋白RBD的抗原性可研发冠状病毒疫苗及抗体药物,帮助疾病诊断。最近德克萨斯州大学奥斯汀分校Jason S. McLellan团队发现ACE2与SARS-CoV-2 S蛋白的结合能力比SARS-CoV更强(约是后者的10-20倍),且挑选的3种SARS-CoV RBD特异性单抗不能结合SARS-CoV-2 RBD[2](意思是SARS-CoV抗体药物未必能治疗SARS-CoV-2感染,得根据SARS-CoV-2 自己的RBD结构设计药物)。

SARS-CoV-2 S蛋白结构图[2]
ACE2受体
ACE2即血管紧张素转化酶II(Angiotensin-converting enzyme 2),是I型整合膜蛋白(这种蛋白1次跨膜,多肽链N端在胞外,C端在胞内),广泛分布于肺部、心脏、肾脏和小肠[4]。ACE2主要包括N端PD区(peptidase domain, 肽酶结构域)和C端CLD区(Collectrin-like domain),其中,位于胞外的PD区可结合新冠病毒S蛋白的RBD [5,6]。在特定蛋白酶的帮助下,S蛋白可诱导ACE2胞外区脱落,继而由ACE2胞内结构来帮助病毒的入侵和感染。宿主细胞表面受体的鉴别对了解病毒的入侵机制和研发新药有重要帮助。
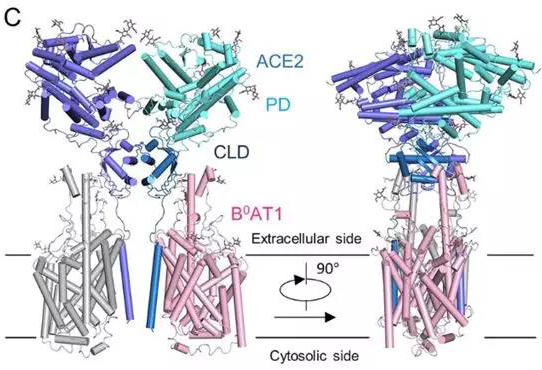
最近,西湖大学周强团队解析了ACE2蛋白的空间结构,如下图。从图中可看出,ACE2以二聚体形式存在,一种氨基酸转运体B0AT1常伴随其出现。
ACE2-B0AT1复合物结构图[6]
S蛋白如何“抓住”ACE2受体?
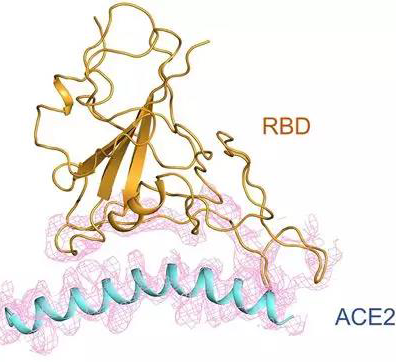
发表ACE2蛋白结构后,周强团队随即又解析了ACE2与新冠病毒S蛋白形成的复合物结构,如下图。他们发现,S蛋白RBD像桥一样横跨在ACE2表面,通过彼此特定的几个氨基酸产生相互作用[4]。
新冠病毒S蛋白RBD与ACE2相互作用[4]
上文介绍了ACE2在冠状病毒感染过程中发挥的关键作用——作为冠状病毒的功能受体,介导病毒入侵和细胞融合。如果说此功能是2003年后,随着对SARS-CoV的研究而发现,那么自2000年ACE2被发现伊始,它的另一个功能——参与肾素-血管紧张素系统(renin-angiotensin system, RAS)对人体血压的调控(间接帮助降血压),则更为人所知。
什么是「RAS」?
RAS(或肾素-血管紧张素-醛固酮系统-RAAS)是人体内调节血压和水电解质平衡的重要激素系统,与心血管疾病、脑血管病、糖尿病等多种疾病相关(下文仅介绍与调节血压相关的内容)。它不仅存在于血循环中(循环RAS),还能独立存在于脑、心脏、肾脏等组织中(局部组织RAS)。RAS涉及多种肽类、酶和受体,下面仅列出主要的几种:
■ 寡肽:AngI(十肽)、AngII(八肽)、Ang-(1–9)(九肽)、Ang-(1–7)(七肽)(Ang=血管紧张素)
■ 酶类:ACE、ACE2(ACE2与ACE是同系物,都属于金属蛋白酶-metalloprotease,它们的催化结构域有42%的同源性)
■ 受体:AT1受体、AT2受体、Mas受体
RAS的2条通路
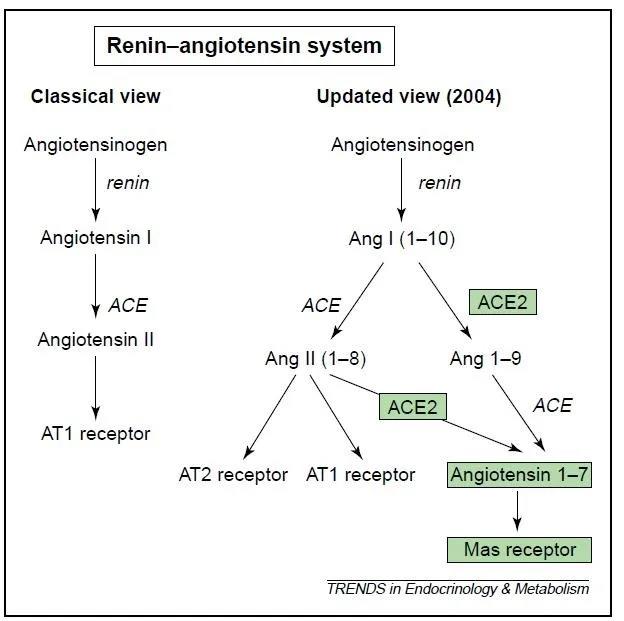
RAS可以简化地理解为有2个彼此关联但作用相反的通路(更专业的说法是“轴-axis”): ACE-AngII-AT1通路和ACE2–Ang-(1–7)-Mas通路(见下图)。
RAS通路图[7]
① ACE-AngII-AT1通路
ACE催化AngI转化为AngII,AngII再与AT1受体结合,使血管收缩;ACE还可作为激肽酶II降解缓激肽(bradykinin,可扩张血管)。以上2点共同引起血管收缩,血压升高。
② ACE2–Ang-(1–7)-Mas通路
ACE2催化AngI转化为Ang-(1–9),ACE继续将Ang-(1–9)转化为Ang-(1–7);ACE2还可直接催化AngII转化为Ang-(1–7)。一方面,这2条途径的共同产物Ang-(1–7)与Mas受体结合,使血管扩张;另一方面,ACE2对AngII的催化效率比AngI高约400倍[7],因此可以抑制ACE-AngII-AT1通路中AngII的合成。以上2方面共同起到降低血压的作用。
RAS系统抑制剂——降压药物
常见的降压药有5种,其中2种是RAS系统抑制剂(由于ACE-AngII-AT1通路的激活会升高血压,因此阻断其中的某些物质可以达到降压目的)。第1个研发出的RAS系统抑制剂是血管紧张素转化酶抑制剂ACEI(angiotensin converting enzyme inhibitor,普利类药物,作用于ACE,对ACE2无作用,抑制AngII的生成),ACEI有干咳的副作用,且可能产生逃逸现象[8](长期使用ACEI后,本应下降的AngII及其所促进分泌的醛固酮水平不降反升,即“AngII逃逸现象”和“醛固酮逃逸现象”)。于是研发了血管紧张素II受体拮抗剂ARB(angiotensin receptor blocker,沙坦类药物,阻断AngII的受体-AT1受体)。目前,ACEI和ARB都是指南中推荐的降压药物。
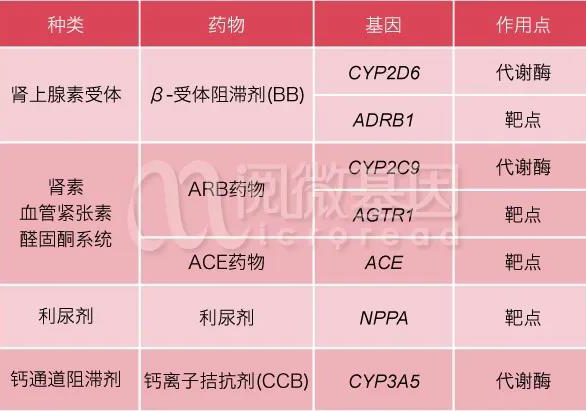
然而,并不是所有患者服用ACEI和ARB后,都有好的降压效果。有些患者服药后,血压可能依然较高或出现严重的副作用。影响药物疗效的因素有很多,其中患者的遗传因素起重要作用。比如患者体内与药物作用相关的基因(主要包括靶点、代谢酶和转运体基因)发生变异,就会影响常规服用药物的疗效。如果能在用药前检测患者的基因型,了解患者对药物的反应,就能为他们提供更好的治疗策略。
研究表明, ACE(该基因编码ACE蛋白,是ACEI药物的作用靶点)和AGTR1(angiotensin II type 1 receptor,该基因编码AT1蛋白,是ARB药物的作用靶点)均存在多态性,会影响患者服用ACEI和ARB类药物的疗效。阅微基因致力于基因检测技术和产品研发,其心血管精准用药项目可以检测与常见5种高血压药物相关的基因多态性,详见下表。
参考文献
[1] Peng Zhou, et al. (2020). A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. DOI: 10.1038/s41586-020-2012-7
[2] Daniel Wrapp, et al. (2020). Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation. bioRxiv. DOI: 10.1101/2020.02.11.944462
[3] Aiping Wu, et al. (2020). Genome Composition and Divergence of the Novel Coronavirus (2019-nCoV) Originating in China. Cell Host&Microbe. DOI: 10.1016/j.chom.2020.02.001
[4] Renhong Yan, et al. (2020). Structural basis for the recognition of the 2019-nCoV by human ACE2. bioRxiv. DOI: 10.1101/2020.02.19.956946
[5] Li F, et al. (2005). Structure of SARS Coronavirus Spike Receptor-Binding Domain Complexed with Receptor. Science. DOI: 10.1126/science.1116480
[6] Renhong Yan, et al. (2020). Structure of dimeric full-length human ACE2 in complex with B0AT1. bioRxiv.DOI: 10.1101/2020.02.17.951848
[7] Louise M Burrell, et al. (2004). ACE2, a new regulator of the renin–angiotensin system. Trends Endocrinol Metab. DOI: 10.1016/j.tem.2004.03.001
[8] J Staessen, et al. (1981). Rise in plasma concentration of aldosterone during long-term angiotension II suppression. J Endocrinol. DOI: 10.1677/joe.0.0910457