MSI的免疫治疗伴随诊断进阶之路
【2022-01-28】
2017年,FDA批准“K药”帕博利珠单抗(Keytruda,默沙东)用于MSI-H实体瘤患者的治疗,“广谱化”的免疫治疗为肿瘤治疗打开了新大门,不仅进一步提高了药企对PD-(L)1的研发热情,也开启了泛癌种生物标记物的新时代。
MSI——首个泛癌种生物标志物
PD-(L)1与MSI的强绑定,使得MSI成为目前最受关注的生物标志物之一,但其实,自1993年被发现后,MSI一直作为林奇综合征初筛的指标,帮助这种遗传性肿瘤综合征从敏感度有限的家族史诊断走向更精准的分子诊断。这项临床意义经历了近20年的验证,因此,目前国内外获批的3款MSI试剂盒,也都以此作为报批的适应症。2010年,研究发现,MSI还可用于II期结直肠癌的预后和化疗指导[1]。
2015年开始,MSI与PD-1药物的疗效关系被发现。2017年,基于5项临床试验(KN-016、164、012、028、158),FDA加速批准了K药用于MSI-H实体瘤患者的治疗,MSI也成为首个泛癌种生物标志物。研究发现,这主要是与机体错配修复系统(MMR)缺陷产生MSI和移码肽有关,后者的免疫原性使MSI-H肿瘤患者对PD-1药物产生应答,也为MSI肿瘤疫苗的研发提供新思路[2-3]。
MSI伴随诊断——免疫伴随诊断的新星
美国很早就开始了伴随诊断(Companion Diagnostics,CDx)的探索与实践,1998年,FDA批准第一个伴随诊断试剂,2014年正式发布伴随诊断指导原则。我国的伴随诊断市场起步相对较晚,但处于快速增长期。国内第一个伴随诊断产品于2018年获批,3年多时间内,已批准20个,主要聚焦于靶向药的伴随诊断。2020-2021年,伴随诊断相关指导原则陆续出台,伴随诊断也借着PD-(L)1免疫治疗热度升起又一个小高潮。
MSI可以用于免疫用药指导,顺理成章就成为伴随诊断的新星。除结直肠癌外,10余种癌种中均发现MSI-H现象,其中,MSI-H阳性率较大的包括子宫内膜癌和胃癌等[4]。2021年,葛兰素史克的PD-1抑制剂就另辟蹊径地选择了子宫内膜癌作为其批准的第一个与MSI相关的适应症。据统计,我国每年新发的MSI-H肿瘤患者数近30万[5]。
MSI在临床上的检测价值被逐渐认可,在医患教育和伴随诊断政策的双重驱动下,MSI的临床渗透率有望逐步提高。从国内外指南的推荐程度来看,2021年,MSI的检测推荐范围从所有新发的结直肠癌、子宫内膜癌患者扩大至晚期胰腺癌、胃癌、小肠腺癌患者。从出台的相关政策来看,2020年至2021年,CMDE连续发布3项新规。此外,据调研,我国目前结直肠癌MSI送检率不足10%,而美国的送检率则高达70%[5],这意味着我国的MSI检测渗透率还有很大的上升空间。
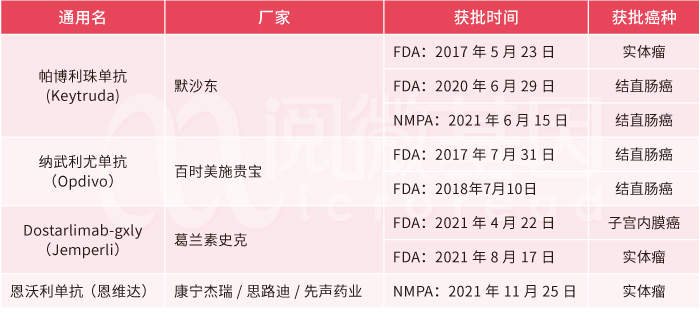
再来看下MSI伴随诊断产品的获批情况。目前,国内已上市12款PD-(L)1,其中,2款获批产品的2个适应症与MSI有关,另有约10个MSI相关适应症正在临床试验或报批阶段,而国内暂未有上市的MSI伴随诊断产品。可以看到,国内MSI伴随诊断市场仍相对空白,存在巨大潜力。
据太平洋证券统计,至2025年,如果子宫内膜癌、结直肠癌和胃癌渗透率按80%计算,其他阳性率高于0.5%的癌种按30%渗透率计算,单次收费按2000元计算的话,则MSI检测市场可达到38.8亿元[5]。
表1 国内外上市的与MSI适应症有关的PD-(L)1
药企服务——基因检测公司的新业务版块
2015年前后,受“精准医学”概念的影响,大量药企开始以投资并购的方式入局基因检测领域,推进个体化用药。近两年,免疫药物伴随诊断则又将药企和基因检测公司的合作推向小高潮,双方战略合作的新闻频出。在3种伴随诊断试剂的开发方式中(共同开发、桥接和跟随),共同开发(Co-development)是未来的趋势,药企和基因检测公司的合作也将贯穿药物和生物标志物的开发至上市全流程,以提高新药的上市率,降低成本。
除新药伴随诊断试剂盒的开发及商业化外,基因检测公司还能为药企提供很多其他服务,如临床试验患者的精准招募,筛选目标人群入组,加速药企临床试验进程;基因大数据的挖掘,促进疾病通路与机制理解,支持创新疗法的研发;biomarker检测服务等。
阅微基因“智阅®基因分析系统”——为客户提供定制化整体解决方案
阅微基因为临床打造的特色CE平台整体解决方案——智阅®基因分析系统,在传承CE平台的高准确性优势的同时,实现了耗材集成化、操作智能化、设置灵活化、空间与光谱校准自动化等颠覆性技术革新,基于6色荧光通道,单管可检测多达60重位点,开辟了国内分子诊断行业中通量检测市场,适应多基因联检和多组学检测趋势,势必为中国分子诊断带来全新技术变革。

阅微基因基于智阅®基因分析系统为客户提供MSI临床检测整体解决方案,与IHC检测结果具有高度一致性,易于判读。未来,阅微基因将持续加速研发,为客户提供更多差异化的创新产品,敬请期待。
参考文献
[1] Daniel J Sargent, et al. (2010). Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol. DOI: 10.1200/JCO.2009.27.1825
[2] Yoshinari Asaoka, et al. (2015). PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med. DOI: 10.1056/NEJMc1510353
[3] Guido Leoni, et al. (2020). A Genetic Vaccine Encoding Shared Cancer Neoantigens to Treat Tumors with Microsatellite Instability. Cancer Res. DOI: 10.1158/0008-5472.CAN-20-1072
[4] Dung T Le, et al. (2017). Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science. DOI: 10.1126/science.aan6733
[5] 创新无界系列之一:泛癌种生物标志物行业研究







