上尿路尿路上皮癌(UTUC)包括肾盂癌和输尿管癌,与膀胱尿路上皮癌(BUC)同属尿路上皮癌(UC)。UTUC约占所有尿路上皮癌的5%~10%,比较少见,侵袭性高。UTUC的遗传特别涉及Lynch综合征(LS),LS是由于MMR基因的胚系突变引起。与普通人群相比,LS患者的UTUC发生率增加了22倍,终身累积风险为6%~15.4%[1]。LS的筛查及诊断对于患者治疗预后及其家属有效的疾病监测和预防具有重要意义。
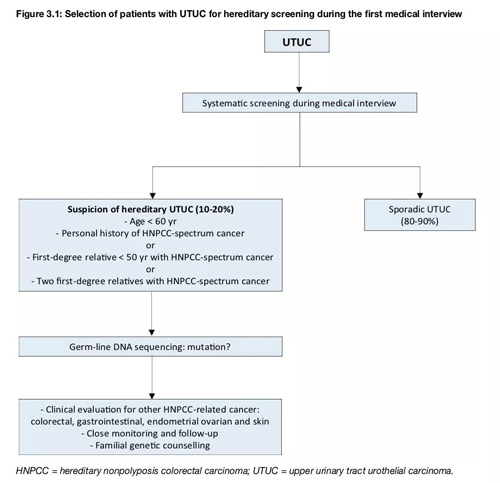
UTUC均应进行MSI检测,高效筛查Lynch综合征
Ju等人在《美国外科病理学杂志》上发表的一项研究检测了UTUC中MMR表达和MSI状态,并将其与BUC进行了比较。研究者从117例UTUC病例和160例BUC病例中获取组织样本和患者信息进行比较,结果发现10例(9%)UTUC有MMR缺失,而BUC只有1%。这些病例中,4/10 (40%)的UTUC存在MSI-H,3/4 dMMR有MSI-H和LS相关的结直肠癌病史;结合其他研究,表明1%~3%的UTUC病例可能是LS相关肿瘤[2]。
2%~6%的结直肠癌(CRC)和子宫内膜癌(EC)与LS相关,LS在UTUC中的实际比例可能与之类似,而目前仅对CRC和EC进行MMR/MSI常规检测。
EAU指南建议对于小于60岁、有个人林奇谱系肿瘤史或家族史等高危因素的UTUC患者进行LS筛查。而在Ju等人的研究中,所有dMMR-UTUC患者的年龄都在60岁以上,几乎都吸烟,且并不是所有患者都有LS相关的癌症个人史,家庭成员的癌症史常缺乏或不完整,组织学特征无明显差异。鉴于UTUC相对少见但在LS患者中有较高的发病率,所以建议诊断指南应推荐对所有UTUC患者进行MMR /MSI检测[2]。
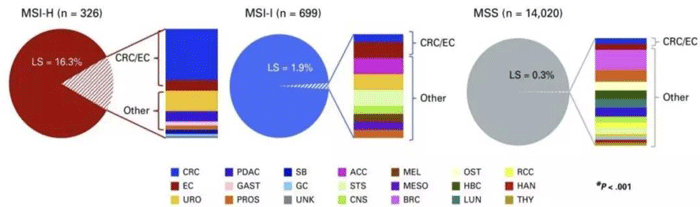
同时,一项包括15045例实体肿瘤患者(超过50种癌症类型)的研究表明,近50%的LS为非CRC/EC肿瘤,LS相关肿瘤谱远大于过去经典研究提示的范围。非CRC / EC肿瘤患者中,若基于家族史,45%不符合LS基因检测标准[3]。
MSI-H/dMMR可预测比目前认可的肿瘤范围更广的LS,因而,无论其肿瘤类型及家族史,具有MSI-H表型的任何肿瘤,均应进行LS相关基因生殖系遗传评估。
不同MSI状态中LS的分布
MSI是UTUC独立的预后因素
侵袭性UTUC预后极差,T2-T3肿瘤5年生存率小于50%,T4或N+/ M+肿瘤不到10%。
UTUC传统的预后因素有年龄、肿瘤分级和分期,MSI是除此之外另一独立的预后因素。
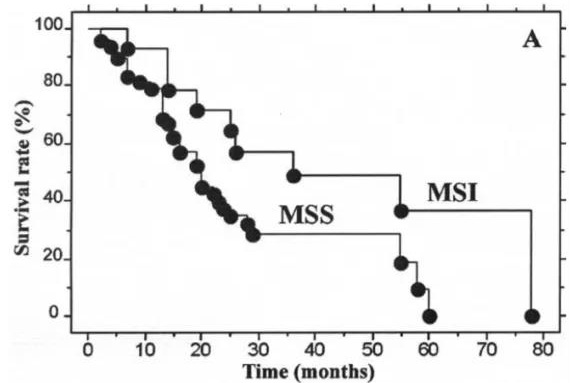
T2-T3N0M0期患者的总体生存曲线
研究表明,在中度预后的患者(T2-T3N0M0)中,MSI分型很好地区分了预后较好或较差的患者,其中MSI-H型患者预后好。所以建议所有侵袭性UTUC患者的MSI都应该被确定,特别是对于T2- T3 N0M0肿瘤患者[4]。
MSI可预测晚期UTUC免疫治疗疗效
2016年至2017年,FDA先后批准Atezolizumab、Nivolumab、Durvalumab、Avelumab及Pembrolizumab 5种PD-1/PD-L1单抗用于铂耐药的晚期UC的二线治疗,以及批准Atezolizumab和Pembrolizumab用于部分不能耐受顺铂化疗患者的一线治疗,开启了晚期UC系统治疗的新篇章。然而,客观反应率低,因此用药前的预测性生物标志物需要确定。
FDA已批准MSI作为泛癌种biomarker指导Pembrolizumab治疗,批准是基于149例15种dMMR / MSI-H肿瘤患者的数据。Pembrolizumab的ORR为39.6%,其中78%的患者反应时间≥6个月。目前MSI检测已经在结直肠癌、子宫内膜癌、胃癌、卵巢癌、宫颈癌、乳腺癌、肝胆癌、前列腺癌、胰腺癌、睾丸癌等十余种癌症的NCCN指南中均有推荐,对于UTUC的研究也证实MSI-H状态与高的突变负荷、LS以及对ICI的持久反应强烈相关[5]。
MSI检测在UTUC中具有非常重要的价值,MSI的临床应用也不再局限于CRC和EC,而是向泛癌种迈进。
参考文献
1.Therkildsen C, et al. (2018). Molecular subtype classification of urothelial carcinoma in Lynch syndrome. Mol Oncol.
DOI:10.1002/1878-0261.12325
2.Ju J Y , et al. (2018). Universal Lynch Syndrome Screening Should be Performed in All Upper Tract Urothelial Carcinomas[J]. The American Journal of Surgical Pathology.
DOI:10.1097/PAS.0000000000001141
3.Microsatellite Instability Is Associated With the Presence of Lynch Syndrome Pan-Cancer[J]. Journal of Clinical Oncology. 2019.
DOI:10.1200/JCO.18.00283
4.Morgan Rouprêt, et al. (2005). Microsatellite instability as predictor of survival in patients with invasive upper urinary tract transitional cell carcinoma[J]. Urology. DOI:10.1016/j.urology.2005.01.019
5.Iyer G, et al. (2017). Mismatch repair (MMR) detection in urothelial carcinoma (UC) and correlation with immune checkpoint blockade (ICB) response. J Clin Oncol.
DOI:10.1200/JCO.2017.35.15_suppl.4511
6.Huang, et al. (2018). Systematic Review: An Update on the Spectrum of Urological Malignancies in Lynch Syndrome[J]. Bladder cancer.
DOI:10.3233/BLC-180180
7.Dharmesh G , et al. (2018). Immune checkpoint inhibitors in urothelial cancer: recent updates and future outlook[J]. Therapeutics and Clinical Risk Management.
DOI:10.2147/TCRM.S158753
8.Metcalfe M J , et al. (2017). Universal Point-of-Care Testing for Lynch Syndrome in Patients with Upper Tract Urothelial Carcinoma[J]. The Journal of Urology.
DOI:10.1016/j.juro.2017.08.002